PENDIENTES FÍSICA Y QUÍMICA 2º ESO
CONTENIDOS A ESTUDIAR
-La medida y el método científico: etapas del método
científico, hipótesis, material básico de laboratorio y normas de seguridad. La
medida (sistema internacional, notación científica, múltiplos y submúltiplos),
diferenciar magnitud de unidad, magnitudes fundamentales y derivadas, cambio de
unidades usando factores de
conversión.
-Masa, volumen y
densidad. Concepto, unidades y ejercicios
sencillos.
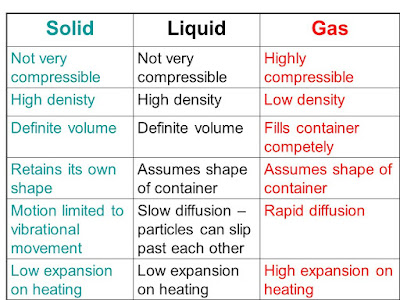
-La materia en la
naturaleza: los tres estados de la
materia y sus propiedades. Los cambios de estado. Gráfica de calentamiento de
una sustancia. Teoría cinética: presión y temperatura.
-Clasificación
de la materia. Elemento, compuesto y mezcla, métodos de
separación de mezclas, disoluciones: tipos y cálculo de la concentración
en g/L.
-El mundo material: los átomos.
Componentes de los átomos: protones, neutrones y electrones. Modelo planetario
del átomo. Número atómico y número másico.
3.- PÁGINA CON EXPLICACIONES Y EJERCICIOS DE CADA UNIDAD
4.- EJERCICIOS DE REFUERZO
5.- PROBLEMAS DE FÍSICA Y QUÍMICA PARA PREPARAR EL EXAMEN5.- CUADERNILLO DE REPASO PARA PRACTICAR
PENDIENTES FÍSICA Y QUÍMICA 3º ESO
CONTENIDOS A ESTUDIAR
- La
medida y el método científico: etapas del método científico, el trabajo en
el laboratorio, material de laboratorio, la medida (sistema internacional,
notación científica, múltiplos y submúltiplos), diferenciar magnitud de
unidad, magnitudes fundamentales y derivadas, cambio de unidades usando
factores de conversión.
- Los
gases y las disoluciones: el estado gaseoso, comportamiento de los gases,
presión, volumen y temperatura de un gas, leyes de los gases, teoría
cinética. Disoluciones: tipos y concentración (% y g/l).
- Estructura
atómica: discontinuidad de la materia, el átomo, modelo atómico de Thomson
y Rutherford, partículas constituyentes del átomo (protones, neutrones y electrones), número
atómico, número másico, isótopos.
- Elementos
y compuestos: Elementos químicos y su ordenación en la tabla periódica de
los elementos. Breve descripción de
la tabla periódica. Formulación y nomenclatura de compuestos binarios
sencillos.